Le cerveau humain est l’un des organes les plus fascinants et complexes de notre corps. Il centralise toutes nos fonctions cognitives, sensorielles, motrices et émotionnelles. Comprendre comment il fonctionne, quelles sont ses structures, et pourquoi il possède des propriétés remarquables comme la plasticité, nous aide non seulement à mieux appréhender notre propre fonctionnement mental, mais aussi les défis des pathologies neurologiques ou psychiatriques.
1. Unités cellulaires fondamentales
Le cerveau compte environ 86 milliards de neurones (Herculano-Houzel, 2009 ; Azevedo et al., 2009). Chaque neurone est constitué :
- d’un corps cellulaire ou soma,
- de prolongements courts et ramifiés, les dendrites, qui reçoivent les signaux entrants,
- d’un prolongement unique et souvent très long, l’axone, qui transmet le signal,
- de terminaisons axonales contenant des vésicules synaptiques remplies de neurotransmetteurs.
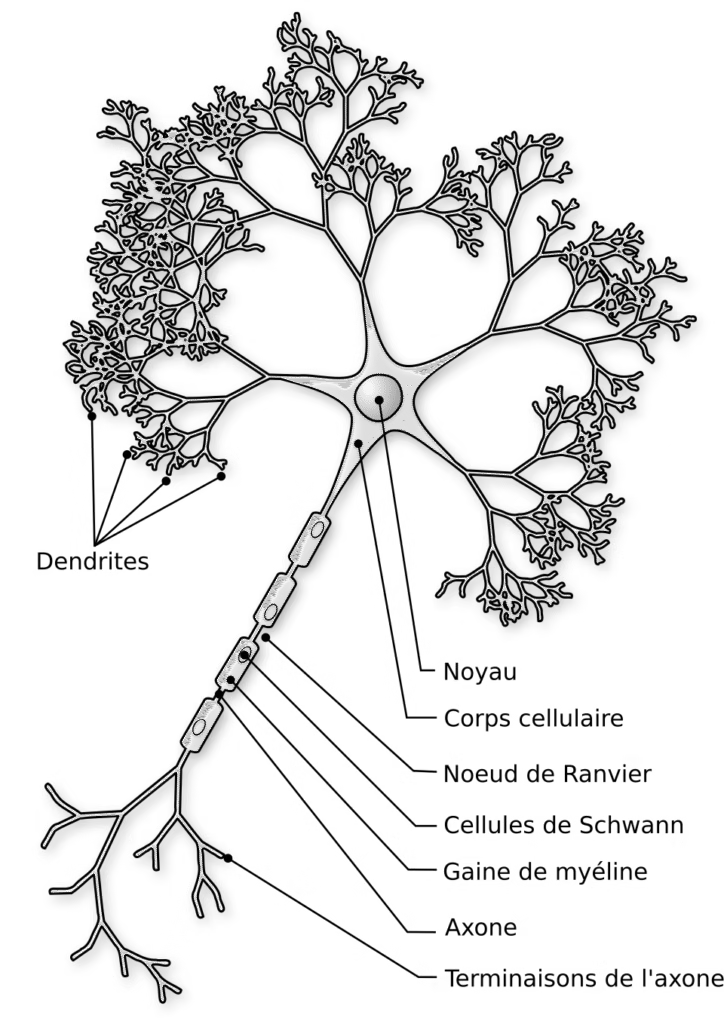
La conduction nerveuse est accélérée par la myéline, gaine lipidique formée par les oligodendrocytes dans le système nerveux central (un oligodendrocyte peut myéliniser jusqu’à 50 segments d’axones).
Les astrocytes régulent l’environnement ionique extracellulaire, recyclent le glutamate et participent à la modulation synaptique.
La microglie assure la surveillance immunitaire et l’élagage synaptique.
2. Transmission de l’information : potentiel d’action et synapse chimique
L’unité élémentaire de communication est le potentiel d’action, onde électrique brève (≈ 1 ms) qui se propage le long de l’axone selon la loi du tout-ou-rien. Au repos, la membrane neuronale est à –70 mV ; la dépolarisation atteint +40 mV par entrée massive de Na⁺ (sodium), suivie d’une repolarisation par sortie de K⁺ (potassium).À l’arrivée du potentiel d’action au bouton synaptique, l’entrée de Ca²⁺ (calcium) déclenche l’exocytose des vésicules. Les neurotransmetteurs (glutamate, GABA, dopamine, etc.) diffusent dans la fente synaptique (20–40 nm) et se fixent sur des récepteurs :
- ionotropes : ouverture directe d’un canal ionique (effet rapide),
- métabotropes : activation de cascades intracellulaires (effet plus lent).
Le glutamate est le principal neurotransmetteur excitateur, le GABA le principal inhibiteur.
3. Organisation anatomique et fonctionnelle
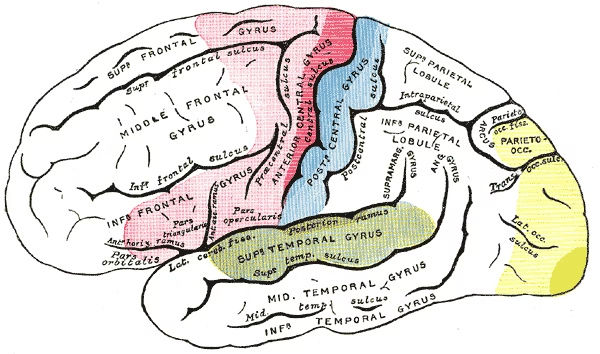
Le néocortex est divisé en lobes et en aires spécialisées, mais toutes coopèrent :
Nous avons le lobe frontal, pariétal, temporal et occipital.
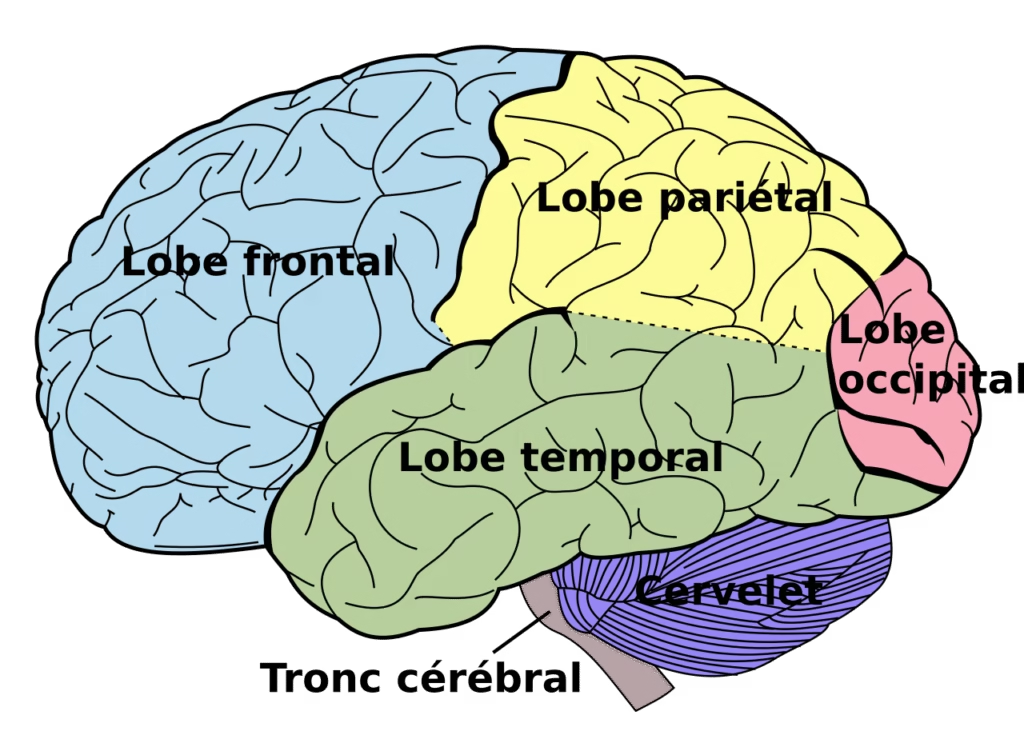
Cortex préfrontal dorsolatéral : mémoire de travail, planification, contrôle exécutif (Miller & Cohen, 2001 ; Fuster, 2001).
Aire de Broca (hémisphère gauche dominant) : production du langage (Broca, 1861 ; Dronkers et al., 2007).
Aire de Wernicke : compréhension du langage (Wernicke, 1874).
Hippocampe : consolidation de la mémoire épisodique et navigation spatiale (Scoville & Milner, 1957 ; O’Keefe & Nadel, 1978).
Amygdale : traitement émotionnel et conditionnement de la peur (LeDoux, 2000).
Cortex visuel primaire (V1) et aires associatives (V5/MT) : analyse des formes, couleurs et mouvements (Hubel & Wiesel, 1962 ; Zeki, 1993).
Insula antérieure : interoception et conscience émotionnelle (Craig, 2009).
Cervelet : coordination motrice et aspects cognitifs (Schmahmann, 2019).
4. Liquide céphalo-rachidien et système glymphatique
Le liquide céphalo-rachidien (LCR), produit à 500 mL/jour par les plexus choroïdes, assure amortissement mécanique et homéostasie. Depuis 2012–2013, on sait qu’il existe un système de drainage parallèle, le système glymphatique : pendant le sommeil lent profond, les espaces périvasculaires s’élargissent de 60 %, le LCR pénètre dans le parenchyme via les aquaporines-4 astrocytaires et évacue β-amyloïde, tau et autres métabolites (Iliff et al., 2012 ; Xie et al., 2013).
5. Plasticité cérébrale : Le cerveau reste modifiable tout au long de la vie :
Le cerveau humain n’est jamais figé ; il conserve une capacité remarquable de modification structurelle et fonctionnelle jusqu’à un âge très avancé. Cette plasticité s’exprime à plusieurs niveaux :
Potentialisation à long terme (LTP)
Mécanisme cellulaire fondamental de l’apprentissage et de la mémoire. Lorsqu’une synapse est fortement et répétitivement stimulée, les récepteurs NMDA laissent entrer du Ca²⁺ dans le neurone post-synaptique. Cette entrée calcique déclenche une cascade de signalisation qui aboutit à l’insertion supplémentaire de récepteurs AMPA dans la membrane post-synaptique, augmentant ainsi l’efficacité de la transmission synaptique pendant des heures, des jours, voire des années (Bliss & Collingridge, 1993).
Neurogenèse adulte
Contrairement à l’ancien dogme selon lequel aucun nouveau neurone n’apparaissait après la naissance, il est désormais établi que de nouveaux neurones continuent d’être produits toute la vie dans le gyrus denté de l’hippocampe (et, à un moindre degré, dans la zone subventriculaire). Ces neurones immatures migrent, s’intègrent aux circuits existants et participent à la formation de nouveaux souvenirs et à l’adaptation émotionnelle (Eriksson et al., 1998 ; Spalding et al., 2013). Cette neurogenèse est stimulée par l’exercice physique, l’enrichissement cognitif et réduite par le stress chronique ou l’âge.
Réorganisation fonctionnelle et structurelle
Après une lésion (AVC, traumatisme) ou lors d’un apprentissage intensif, le cerveau peut réattribuer des fonctions à d’autres régions :
– Exemple célèbre : les chauffeurs de taxi londoniens, qui doivent mémoriser des dizaines de milliers de rues, présentent une hypertrophie significative de la partie postérieure de l’hippocampe, avec un volume plus important corrélé à leurs années d’expérience (Maguire et al., 2000).
– Après un AVC, des zones intactes (même de l’hémisphère controlatéral) peuvent progressivement prendre en charge les fonctions perdues grâce à un remodelage des connexions et une augmentation de la densité synaptique.
Ces trois mécanismes – LTP, neurogenèse adulte et réorganisation corticale – expliquent pourquoi il est possible d’apprendre une langue étrangère à 70 ans, de récupérer partiellement après une lésion cérébrale grave ou d’améliorer ses performances cognitives par un entraînement régulier. La plasticité cérébrale est donc non seulement un phénomène de développement, mais une propriété permanente du cerveau humain sain.
En bref…
Le cerveau humain est un réseau de 86 milliards de neurones soutenu par un nombre équivalent de cellules gliales, fonctionnant grâce à des potentiels d’action et une transmission synaptique chimique précise. Il est organisé en régions hautement spécialisées mais interconnectées, protégé et nettoyé chaque nuit par le système glymphatique, et capable de se remodeler en permanence grâce à la plasticité neuronale. Prendre soin de son sommeil, de son activité physique et cognitive, et limiter le stress chronique constitue la meilleure façon de préserver et optimiser cet organe exceptionnel.
Bibliographie
- Azevedo, F. A. C., Carvalho, L. R. B., Grinberg, L. T., Farfel, J. M., Ferretti, R. E. L., Leite, R. E. P., Jacob Filho, W., Lent, R., & Herculano-Houzel, S. (2009). Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology, 513(5), 532–541. https://doi.org/10.1002/cne.21974
- Bliss, T. V. P., & Collingridge, G. L. (1993). A synaptic model of memory: Long-term potentiation in the hippocampus. Nature, 361(6407), 31–39. https://doi.org/10.1038/361031a0
- Broca, P. (1861). Remarques sur le siège de la faculté du langage articulé, suivies d’une observation d’aphémie (perte de la parole). Bulletin de la Société Anatomique, 6, 330–357.Craig, A. D. (Bud). (2009). How do you feel — now? The anterior insula and human awareness. Nature Reviews Neuroscience, 10(1), 59–70. https://doi.org/10.1038/nrn2555
- Dronkers, N. F., Plaisant, O., Iba-Zizen, M. T., & Cabanis, E. A. (2007). Paul Broca’s historic cases: High resolution MR imaging of the brains of Leborgne and Lelong. Brain, 130(5), 1432–1441. https://doi.org/10.1093/brain/awm042
- Eriksson, P. S., Perfilieva, E., Björk-Eriksson, T., Alborn, A.-M., Nordborg, C., Peterson, D. A., & Gage, F. H. (1998). Neurogenesis in the adult human hippocampus. Nature Medicine, 4(11), 1313–1317. https://doi.org/10.1038/3305
- Fuster, J. M. (2001). The prefrontal cortex — an update: Time is of the essence. Neuron, 30(2), 319–333. https://doi.org/10.1016/S0896-6273(01)00285-9
- Herculano-Houzel, S. (2009). The human brain in numbers: A linearly scaled-up primate brain. Frontiers in Human Neuroscience, 3, Article 31. https://doi.org/10.3389/neuro.09.031.2009
- Hubel, D. H., & Wiesel, T. N. (1962). Receptive fields, binocular interaction and functional architecture in the cat’s visual cortex. Journal of Physiology, 160(1), 106–154. https://doi.org/10.1113/jphysiol.1962.sp006837
- Iliff, J. J., Wang, M., Liao, Y., Plogg, B. A., Peng, W., Gundersen, G. A., Benveniste, H., Vates, G. E., Deane, R., Goldman, S. A., Nagelhus, E. A., & Nedergaard, M. (2012). A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Science Translational Medicine, 4(147), 147ra111. https://doi.org/10.1126/scitranslmed.3003748
- LeDoux, J. E. (2000). Emotion circuits in the brain. Annual Review of Neuroscience, 23, 155–184. https://doi.org/10.1146/annurev.neuro.23.1.155
- Maguire, E. A., Gadian, D. G., Johnsrude, I. S., Good, C. D., Ashburner, J., Frackowiak, R. S. J., & Frith, C. D. (2000). Navigation-related structural change in the hippocampi of taxi drivers. Proceedings of the National Academy of Sciences, 97(8), 4398–4403. https://doi.org/10.1073/pnas.070039597
- McEwen, B. S., Nasca, C., & Gray, J. D. (2015). Mechanisms of stress in the brain. Nature Neuroscience, 18(10), 1353–1363. https://doi.org/10.1038/nn.4086
- Miller, E. K., & Cohen, J. D. (2001). An integrative theory of prefrontal cortex function. Annual Review of Neuroscience, 24, 167–202. https://doi.org/10.1146/annurev.neuro.24.1.167
- Nedergaard, M., & Goldman, S. A. (2016). Brain drain: The glymphatic system and its role in clearance of amyloid-β. Science, 352(6287), Article 1333.
- O’Keefe, J., & Nadel, L. (1978). The hippocampus as a cognitive map. Clarendon Press.Ramachandran, V. S., & Hirstein, W. (1998). The perception of phantom limbs: The D. O. Hebb lecture. Brain, 121(9), 1603–1630. https://doi.org/10.1093/brain/121.9.1603
- Scoville, W. B., & Milner, B. (1957). Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery & Psychiatry, 20(1), 11–21. https://doi.org/10.1136/jnnp.20.1.11
- Spalding, K. L., Bergmann, O., Alkass, K., Bernard, S., Salehpour, M., Huttner, H. B., Boström, E., Westerlund, I., Vial, C., Buchholz, B. A., Possnert, G., Mash, D. C., Druid, H., & Frisén, J. (2013). Dynamics of hippocampal neurogenesis in adult humans. Cell, 153(6), 1219–1227. https://doi.org/10.1016/j.cell.2013.05.002
- Wernicke, C. (1874). Der aphasische Symptomencomplex: Eine psychologische Studie auf anatomischer Basis. Cohn & Weigert.
- Xie, L., Kang, H., Xu, Q., Chen, M. J., Liao, Y., Thiyagarajan, M., O’Donnell, J., Christensen, D. J., Nicholson, C., Iliff, J. J., Takano, T., Deane, R., & Nedergaard, M. (2013). Sleep drives metabolite clearance from the adult brain. Science, 342(6156), 373–377. https://doi.org/10.1126/science.1241224
- Zeki, S. (1993). A vision of the brain. Blackwell Scientific Publications.
FAQ express
Q1 : C’est quoi un potentiel d’action ?
Une impulsion électrique de 1 ms qui court le long de l’axone (loi du tout-ou-rien).
Q2 : Pourquoi dormir est vital ?
Pour activer le système glymphatique et évacuer les déchets neurotoxiques.
Q3 : Le stress abîme-t-il vraiment le cerveau ?
Oui, de manière chronique, le cortisol entraîne une atrophie de l’hippocampe et du cortex préfrontal (McEwen et al., 2015).
Q4 : On fabrique encore des neurones adultes ?
Oui, surtout dans le gyrus denté (Spalding et al., 2013).
Q5 : On utilise uniquement 10 % de notre cerveau ?
100 % faux. Toutes les régions travaillent, juste pas en même temps.
Marius François – Psychologue clinicien, Psychothérapeute, Hypnose, EMDR – Moulins (03)






